血糖仪产品技术要求¶
医疗器械产品技术要求编号:
版本: v1.0
文档编号: SOP-13
生效日期: 2025年12月17日
1. 产品型号/规格及其划分说明¶
1.1 产品规格型号¶
型号: GDHFAD Meter Plus和Meter Mini血糖仪
型号含义: "GDH" 代表产品采用葡萄糖脱氢酶(Glucose Dehydrogenase)作为核心检测酶,"FAD" 代表酶的特定亚型(如黄素腺嘌呤二核苷酸依赖型,确保反应特异性),无细分规格,所有该型号产品核心性能、结构组成一致,仅配件搭配(如是否含备用电池)可能因销售套餐略有差异。
1.1.1 软件名称¶
GDHFAD 血糖仪血糖检测与数据处理内部工作程序
1.1.2 发布版本:V1¶
1.1.3 完整版本:V1.0.0.0¶
1.1.4 软件命名规则¶
V X.Y.Z.B
其中: - V - Version简写 - X - 主版本号,表示重大增强类软件更新;当功能模块或者算法有较大的变动后,如增加多个功能模块或者整体架构发生变化,此主版本号增1 - Y - 子版本号:表示轻微增强类软件更新;当功能有一定的增加或变化后,如增加了对操作功能权限控制,增加设备控制指令,此子版本号增1 - Z - 阶段版本号:表示纠正类软件更新;一般是软件Bug修复或一些微小变动后,如界面图片有修改,界面功能说明文字有增删等情况要经常发布阶段性版本,时间间隔不限,修复一个Bug即可发布一个阶段性版本,每发布一个阶段性版本,此阶段版本号增1 - B - 构建版本号:此版本号用于标注当前版本第几次编译生成可执行程序
2. 性能要求¶
2.1 外观与结构¶
2.1.1 血糖仪产品外形应端正,表面应光亮整洁,不得有锋棱、毛刺、破损和变形¶
2.1.2 血糖仪的控制面板上文字和标志应准确、清晰、牢固¶
2.1.3 显示屏上的显示字迹应无乱码、错码和缺笔画现象¶
2.1.4 试纸插槽端口平滑、边缘无毛刺,确保 GDHFAD 专用血糖试条顺畅插入且接触良好¶
2.1.5 功能按键(电源、查询、退条等)按压灵活、回弹可靠,电池仓、外壳紧固件无松动¶
2.2 血糖浓度显示范围¶
血糖仪血糖浓度显示范围为0.6mmol/L~33.3mmol/L(20mg/dL~600mg/dL),超出范围时显示屏应清晰显示 "LO"(<0.6mmol/L)或 "HI"(>33.3mmol/L)。
2.3 血糖仪测量范围¶
2.3.1 血糖仪测量范围为 2.2mmol/L27.8mmol/L(40mg/dL500 mg/dL) ,线性相关系数r不小于0.95¶
2.3.2 血糖仪重复性¶
血糖分析仪重复测量结果的精密度应符合表1的要求:
表1 重复性要求
| 测试范围 | 精密度 |
|---|---|
| 2.2mmol/L ~ 5.5mmol/L(40mg/dL ~ 100mg/dL) | SD<0.42 mmol/L(<7.7 mg/dL) |
| 5.6mmol/L ~ 27.8mmol/L(100mg/dL ~ 500mg/dL) | CV<7.5% |
2.3.3 血糖仪准确度¶
血糖仪准确度应符合下列要求之一:
a) 血糖仪测量结果偏差的95%应符合表2的要求; b) 血糖仪对葡萄糖的回收率为80%~120%。
表2 准确度要求
| 测试范围 | 允许偏差 |
|---|---|
| 0.6mmol/L ~ 5.5mmol/L(11mg/dL ~ 100mg/dL) | 不超过±0.83 mmol/L(±15 mg/dL) |
| 5.5mmol/L ~ 33.3mmol/L (100 mg/dL~ 600mg/dL) | 不超过±16% |
2.3.4 血糖分析仪的质控物质测量结果的95%应在质控范围之内。¶
2.3.5 变化环境条件(温度 5℃~45℃、湿度 ≤90% RH)下,上述误差要求仍需满足;¶
2.3.6 红外血糖仪在显示范围外不提供读数,显示 "LO"(<0.6mmol/L)或 "HI"(>33.3mmol/L)。¶
2.4 抗跌落性¶
从垂直距离 1m 高处,以 "正面、侧面、试纸插槽端" 三种姿态自由跌落到硬质表面(密度>700kg/m³ 的硬质木块),跌落後仪器功能正常,无部件损坏,且按 2.3.1要求测试准确度仍达标。
2.5 指示单元¶
2.5.1 分辨力¶
显示屏血糖值分辨力为 0.1mmol/L(或 1mg/dL,依单位设置)。
2.5.2 显示¶
血糖值显示字符高度≥4mm,确保不同视力人群可清晰读取;
2.5.3 提示功能¶
- 低电量提示:当供电电压≤2.5±0.2V 时,电量符号闪烁并伴随 "哔" 声警示;
- 环境异常提示:当环境温度<10℃或>40℃时,显示屏显示对应错误代码(如 "E-2" 表示温度异常),并发出警示音;
- 试纸错误提示:插入非 GDHFAD 专用试条、过期试条或未正确插入试条时,显示 "E-3""E-4" 等错误代码;
2.5.4 模式¶
具备 "血糖检测模式""质控检测模式"(用于验证 GDHFAD 血糖测试条有效性)。
2.6 产品的清洁和消毒¶
- 用 75% 酒精棉片擦拭血糖仪外壳、显示屏、试纸插槽外侧(非内部电路),清洁消毒后:
- 准确度仍符合 2.3 要求;
- 外壳文字、标志无模糊或脱落;
- 禁止使用汽油、强酸碱等腐蚀性清洁剂。
2.7 正常工作状态¶
插入 GDHFAD 专用试条后,仪器自动开机自检,发出 "哔" 声提示,待滴血符号闪烁时吸入血样(约 3μL),5 秒内完成检测并显示血糖值,无卡顿、死机现象。
2.8 自检功能¶
开机后 LCD 显示屏全亮(所有符号点亮),持续时间≥0.1 秒,自检无异常后进入 "滴血待检测" 状态;若自检异常(如内部电路故障),则显示对应错误代码(如 "E-6")。
2.9 自动关机功能¶
检测完成后无操作、或滴血等待 3 分钟无血样吸入、或待机 1 分钟无操作,仪器自动关机,降低功耗。
2.10 记忆功能¶
可存储最近 500 组(或根据设计需求调整)血糖测试数据,含测量时间与血糖值,支持按时间顺序查询,新数据存储时自动覆盖最早数据。
2.11 电气安全评价¶
符合 GB9706.1-2020《医用电气设备 第 1 部分:安全通用要求》,防电击类型为 "内部电源设备",防电击程度为 "B 型应用部分"。
2.12 电磁兼容¶
符合 YY 0505-2012《医用电气设备 第 1-2 部分:安全通用要求 并列标准:电磁兼容 要求和试验》,在常见射频环境(如手机、微波炉)下,检测结果不受干扰。
2.13 环境试验要求¶
- 气候环境试验:符合 GB/T 14710-2009 中 Ⅱ 组要求,如低温贮存(-20℃,4h)、高温贮存(55℃,4h)、湿热贮存(40℃,93% RH,48h)后,仪器功能正常、准确度达标;
- 机械环境试验:符合 GB/T 14710-2009 中 Ⅱ 组振动、碰撞要求;
- 运输试验:正常包装状态下,经公路 / 铁路运输模拟试验后,全性能(除 2.11、2.12 外)符合要求;
- 电源电压适应能力:使用配套电池(如1个纽扣电池,DC 3V),电压在 2.7V~3.3V 范围内波动时,准确度仍符合 2.3 要求。
具体的实验要求和检测项目见下表3。
表3 环境实试验项目、试验要求及检测项目
| 试验项目 | 试 验 要 求 | 检 测 项 目 | 备注 | |||||
|---|---|---|---|---|---|---|---|---|
| 箱内试验时间 h | 箱内持续时间 h | 恢复时间 h | 中间检测 | 最后检测 | 电源电压适应能力试验 | |||
| 2.7 V | 3.15 V | |||||||
| 常温试验 | - | - | - | - | 全性能 | - | - | - |
| 额定工作低温试验16℃ | 1 | - | - | - | 2.2, 2.3.1 | 2.2, 2.3.1 | - | 通电 |
| 低温贮存试验-20℃ | 4 | - | 4 | - | - | - | - | |
| 额定工作高温试验35℃ | 1 | - | - | 2.2, 2.3.1 | - | 2.2, 2.3.1 | 通电 | |
| 运行试验 | 4 | - | - | - | - | 2.2, 2.3.1 | 通电 | |
| 高温贮存试验55℃ | 4 | - | 4 | - | - | - | - | |
| 额定工作湿热试验35℃ 85%RH | 4 | - | - | - | - | - | 通电 | |
| 湿热贮存试验40℃ 93%RH | 48 | - | 24 | - | - | - | - | - |
| 振动碰撞试验 | 一个试验方向、正常工作位置 | - | 2.1 | - | - | - | ||
| 运输试验 | 正常包装状态 | - | 全性能(2.11、2.12除外) | - | - | - |
3. 试验方法¶
正常工作条件
a)环境血糖浓度:5℃~45℃; b)相对湿度:≤90%; c)大气压力:70kPa~106kPa; d)电源条件:内部直流电源:DC 3.0V (1个纽扣电池)。
实验条件: 需按符合GB/T 21417.1-2008 5.1和5.2所规定的实验条件进行试验。
3.1 外观与结构试验¶
以目力观察和手感检查,结果应符合2.1的要求。
3.2 血糖浓度显示范围试验¶
用浓度 0.5mmol/L("LO" 临界点)、33.3mmol/L("HI" 临界点)的标准糖液测试,确认仪器显示 "LO""HI"; 记录本设备显示的血糖浓度读数,结果应符合2.2的要求。
3.3 血糖仪测量范围¶
3.3.1 血糖仪测量范围试验¶
参考《GB/T 19634-2005 体外诊断检验系统 自测用血糖监测系统通用技术条件》,取加入了肝素抗凝剂的静脉全血样品最终使7份样品葡萄糖浓度分别在表5范围之内,且第1份、第7份分别为接近2.2 mmol/L、27.8 mmol/L。将准备好的样品分为两等份,其中一等份使用分析仪进行葡萄糖测量,另一等份用两台血糖分析仪和同一批号血糖试纸条测量各10次,每份测量样品中,分析仪测量值为xi,血糖分析仪测量值为yi,依照公式(1)计算两组数据的相关系数。结果应符合2.3.1的要求。
式中:
- \(r\) — 相关系数
- \(n\) — 样品数量
- \(x_i\) — 第i份样品的分析仪测量值
- \(y_i\) — 第i份样品的血糖分析仪测量值
- \(\bar{x}\) — 分析仪测量值的平均值
- \(\bar{y}\) — 血糖分析仪测量值的平均值
3.3.2 血糖分析仪重复性试验¶
采集红细胞压积为0.35L/L至0.50L/L(35% 至50%)的血样提供者的空腹新鲜静脉全血,注入加有肝素或EDTA抗凝剂的试管中,避免溶血。将样本放置在室温(23±5)℃平衡,使样本温度达到室温±2℃,作为试验开始时的温度。应该用血糖浓度范围落在表4中的5份静脉全血样本进行重复性试验。每份样本在进行测试之前,应轻轻倒转,使其充分混匀。每份样本的浓度应该用分析仪进行确定。然后分别在两台血糖分析仪上按照生产者的常规测量程序重复测试20次。计算结果的标准差(SD)和变异系数(CV),结果应符合2.3.2的要求。
表4 重复性试验血糖浓度范围
| 血糖浓度[mmol/L(mg/dL)] |
|---|
| 2.2 ~ 2.8(40 ~ 50) |
| 2.9 ~ 6.1(51 ~ 110) |
| 6.2 ~ 8.3(111 ~ 150) |
| 8.4 ~ 13.9(151 ~ 250) |
| 14.0 ~ 22.2(251 ~ 400) |
注: 可以用0.9%生理盐水配制的等份葡萄糖液对静脉血样本中的葡萄糖浓度进行调整。稀释的程度不应该影响样本的基质。应在样本中加入足量的、符合生产者建议且不会干扰血糖检测的防腐剂(如:马来酰亚胺、氟化物、或一碘化醋酸盐溶液)以避免发生糖酶解。为了获得低葡萄糖浓度血样本,可以将抗凝血样本放置过夜,使其葡萄糖浓度下降至所需的水平。
3.3.3 血糖分析仪准确度试验¶
测试静脉血样(替代毛细血管血样)。
3.3.3.1 对比试验¶
使用血糖浓度范围落在表5中的50份静脉全血样本。在用每份样本进行试验之前,要轻轻倒转,使其充分混匀。每份静脉血样都分为3部分,第1部分用第1台血糖分析仪测试,第2部分用第2台血糖分析仪测试,应按照生产者的常规测量程序进行;第3部分高速离心,取出血浆后使用分析仪进行血糖测试。每台血糖分析仪测试的静脉全血结果 \(\bar{y_i}\) 与分析仪测试的结果 \(\bar{x_i}\) 之间的差异即为准确度偏差,结果应符合2.3.3第a条款要求。
准确度计算公式:
绝对偏差:
相对偏差:
式中:
- \(\bar{y_i}\) — 血糖分析仪测试的静脉全血结果
- \(\bar{x_i}\) — 分析仪测试的结果
表5 准确度试验用血糖浓度范围
| 样品数量 | 血糖浓度[mmol/L(mg/dL)] |
|---|---|
| 2 | <2.8 (<50) |
| 8 | 2.8~4.3(50~80) |
| 10 | 4.4~6.7(81~120) |
| 15 | 6.7~11.1(121~200) |
| 8 | 11.2~16.6(201~300) |
| 5 | 16.7~22.2(301~400) |
| 2 | >22.2(>400) |
注: 血糖浓度在2.8mmol/L~22.2mmol/L(50mg/dL~400mg/dL)范围内的样品应由原始样品获得。
可以按照如下方法获得两端的极限浓度样品:将血样收集在加有抗凝剂的试管中,将其在37℃温箱中孵育过夜使血糖酵解,即可获得血糖浓度< 2.8mmol/L的样品;将血样收集在加有抗凝剂的试管中,然后加入适当的葡萄糖,即可获得血糖浓度> 22.2mmol/L的样品。
3.3.3.2 回收试验¶
取加入了肝素抗凝剂的静脉全血样品S1,可在样品中加入足量的、符合制造商建议且不会干扰血糖检测的防腐剂以避免发生糖酶解。准确吸取7等份S1(体积为V1),在其中6份中分别加入V2(S2)、V3(S3)、V4(S4)、V5(S5)、V6(S6)、V7(S7)已知浓度的标准葡萄糖生理盐水溶液,最终使7份样品葡萄糖浓度分别在表5的范围之内。每份样品分别轻轻倒转充分混匀,用2台血糖分析仪和同一批号血糖试纸条分别测试7份样品各10次,10次测量平均值分别记为C1、C2、C3、C4、C5、C6、C7按下列公式计算血糖分析仪和血糖试纸条的葡萄糖回收率,测试结果应符合2.3.3第b条款要求。
式中: - \(R\) — 回收率 - \(n=1,2,3,4,5,6\) - \(i=2,3,4,5,6,7\) - \(V_i\) — \(S\) 与 \(S_i\) 两样品间加入的葡萄糖生理盐水溶液体积 - \(V_1\) — \(S_1\) 样品的体积 - \(C_i\) — \(S_i\) 样品的测定浓度 - \(C_1\) — \(S_1\) 样品的测定浓度 - \(C_s\) — 配制的葡萄糖液的浓度
3.3.4 血糖分析仪质控物质¶
以同一台血糖仪、同一批血糖试纸条重复测量20次质控物浓度,应符合2.3.4的要求。
3.3.5 在变化环境条件(温度 5℃~45℃、湿度 ≤90% RH)下,重复上述测试,测试误差要求符合2.3.5要求;¶
3.3.6 用浓度 0.5mmol/L("LO" 临界点)、33.3mmol/L("HI" 临界点)的标准糖液测试,确认仪器显示 "LO""HI",不提供读数;测试结果应符合2.3.6的要求。¶
3.4 跌落性试验¶
按 2.4 要求完成 3 次跌落,跌落後用 5.0mmol/L 标准糖液测 3 次,误差符合 2.3 要求,且按键、显示屏、试纸插槽功能正常。跌落试验后,按3.3.1进行测试,结果应符合2.4的要求。
3.5 指示单元试验¶
3.5.1 分辨力¶
目力观察显示屏数值,确认分辨力与字符高度,结果应符合2.5.1。
3.5.2 显示¶
实际操作切换 "检测模式""质控模式",确认功能正常,结果应符合2.5.2。
3.5.3 提示/报警功能¶
-
血糖浓度超限提示试验: 在实验室参考条件(温度 23±2℃、相对湿度 50%±10% RH、大气压力 70kPa~106kPa)下,将 GDHFAD 血糖仪及配套标准糖液(浓度 0.5mmol/L,对应 "LO" 临界值;33.3mmol/L,对应 "HI" 临界值)平衡至少 30 分钟。 取 0.5mmol/L 标准糖液,按正常检测流程吸入试条,重复测量 3 次,观察仪器显示,应准确显示 "LO" 及对应提示(如 "血糖过低"),符合 2.5.3 要求; 取 33.3mmol/L 标准糖液,同法重复测量 3 次,观察仪器显示,应准确显示 "HI" 及对应提示(如 "血糖过高"),符合 2.5.3 要求。
-
环境温湿度异常提示试验: a) 测试前,将 GDHFAD 血糖仪在实验室参考条件下稳定 30 分钟,随后分别置于以下环境: b) 低温环境:<16±1℃(如 15℃)、相对湿度 50%±10% RH,放置 30 分钟后,插入试条尝试检测,仪器应显示温度异常代码(如 "E-2")并发出警示音,符合 2.5.3c 要求; c) 高温环境:>35±1℃(如 36℃)、相对湿度 50%±10% RH,放置 30 分钟后,同法检测,仪器应显示温度异常代码(如 "E-2")并发出警示音,符合 2.5.3d 要求。
3.5.4 低电压提示功能测试¶
用直流稳压电源代替血糖仪的直流内部电源。降低电压直到2.5V±0.2V时,血糖仪应出现一个低电量的指示或者警告,或者显示开始黯淡不清,结果应符合2.5.4的要求。
3.5.5 模式¶
实际操作 GDHFAD 血糖仪,按说明书步骤切换模式:
从默认 "血糖检测模式" 切换至 "质控检测模式"(用于验证试条有效性),观察显示屏是否出现 "质控模式" 标识;
在 "质控模式" 下插入试条、吸入质控液,确认仪器可正常完成质控检测并显示结果,切换过程无卡顿,功能符合 2.5.5 要求。
3.6 产品的清洁和消毒¶
a) 按以下步骤对 GDHFAD 血糖仪进行试验,模拟日常清洁场景: b) 准备 75% 医用酒精、蒸馏水两种清洁试剂,分别用软棉布蘸取对应试剂; c) 用蘸取酒精的棉布轻拭仪器外壳、显示屏、试纸插槽外侧(避免液体渗入内部电路),每擦拭 1 次后自然晾干,重复操作 20 次; d) 同法用蘸取蒸馏水的棉布重复清洁 20 次; e) 清洁后检查: f) 目测仪器表面,应光亮整洁,无试剂残留、外壳腐蚀痕迹; g) 检查外壳文字、标志(如滴血符号、操作提示),应无模糊、脱落; h) 按 3.3.1(准确度试验)方法,用 5.0mmol/L 标准糖液测量 3 次,误差需符合 2.6 要求(即与清洁前准确度一致,无明显偏差)。
3.7 正常工作状态试验¶
a) 准备 GDHFAD 血糖仪、配套新试条、5.0mmol/L 标准糖液,在实验室参考条件下平衡 30 分钟; b) 插入试条,仪器自动开机自检,待滴血符号闪烁后,将试条吸样端接触标准糖液,确认血样被顺利吸入; c) 观察仪器操作流程:应在 5 秒内完成检测并显示血糖值(误差需在 ±0.83mmol/L 内),无死机、卡顿、显示异常,符合 2.7 要求。
3.8 自检功能试验¶
a) 按下 GDHFAD 血糖仪电源键开机,观察显示屏状态; b) 仪器应首先进入自检模式,LCD 显示屏全亮(所有符号、数字点亮,如 "888""滴血符号""电量符号"),持续时间≥0.1 秒; c) 自检完成后,显示屏应切换至 "滴血待检测" 状态(显示滴血符号或 "---"),无错误代码提示,符合 2.8 要求;若自检异常(如内部电路故障),应显示对应错误代码(如 "E-6"),提示功能正常。
3.9 自动关机功能试验¶
a) 开机后不插入试条,保持待机状态,计时观察:1 分钟内无任何操作,仪器应自动关机,符合 2.9 要求; b) 插入试条,待滴血符号闪烁后不吸入血样,计时观察:3 分钟内无操作,仪器应自动关机,符合 2.9 要求; c) 完成一次正常检测(显示血糖值)后不拔出试条,计时观察:3 分钟内无操作,仪器应自动关机,符合 2.9 要求。
3.10 记忆功能¶
a) 准备 10 组不同浓度的标准糖液(如 1.0mmol/L、3.0mmol/L、5.0mmol/L…20.0mmol/L),按浓度从低到高依次完成检测,每组检测后记录仪器显示的存储序号; b) 检测完成后,按说明书步骤进入 "历史数据查询" 模式,依次查看存储数据:应能完整显示 10 组血糖值及对应检测时间(若仪器具备时间记录功能),无数据丢失、错乱; c) 再进行 1 次新检测(第 11 组),查询历史数据:最早存储的第 1 组数据应被自动覆盖,仅保留后 10 组数据,符合 2.10 要求(注:若仪器设计记忆容量为其他数量,按对应容量调整试验组数)。
3.11 电气安全评价试验¶
a) 按 GB9706.1-2020《医用电气设备 第 1 部分:安全通用要求》规定的方法进行试验,重点检测: b) 防电击保护:检查设备外壳绝缘性能、接地连续性(若有),确保无漏电风险; c) 电源电压适应:在 2.7V~3.3V 电压范围内,仪器仍能正常工作,准确度符合要求; d) 过载保护:模拟电池短路场景,仪器应具备保护机制,无损坏、起火风险; e) 试验结果需符合 2.11 要求。
3.12 电磁线兼容性¶
a) 按 YY 0505-2012《医用电气设备 第 1-2 部分:安全通用要求 并列标准:电磁兼容 要求和试验》规定的方法进行试验,包括: b) 电磁发射试验:检测仪器工作时的射频辐射、传导发射,需符合 "1 组 B 类" 限值; c) 电磁抗扰度试验:模拟静电放电(±8kV 空气放电)、射频电磁场(3V/m)、工频磁场(3A/m)等干扰场景,仪器检测结果误差需仍符合 2.3(准确度)要求,无死机、显示异常,符合 2.12 要求。
3.13 环境试验¶
GDHFAD 血糖仪的环境试验按 GB/T 14710-2009《医用电气设备 环境要求及试验方法》
4. 术语¶
无
附录A¶
A.1 产品特征¶
A 1.1 按防电击类型分类:内部电源;
A 1.2 按防电击的程度分类: B 型应用部分;
A 1.3 按对进液的防护程度分类:不防进液;
A 1.4 按在与空气混合的易燃麻醉气或与氧或氧化亚氮混合的易燃麻醉气情况下使用时的安全程度分类:非AP/APG设备;
A 1.5 按运行模式分类:连续运行;
A 1.6 设备的额定电压:DC3V(1个纽扣电池);
A 1.7 设备是否具有对除颤放电效应防护的应用部分:不具有;
A 1.8 设备是否具有信号输出或输入部分:无;
A 1.9 永久性安装设备或非永久性安装设备:非永久;
A 1.10 电磁兼容组别:按GB4824 分组为1组B类;
A 1.11 电气绝缘图(下图):
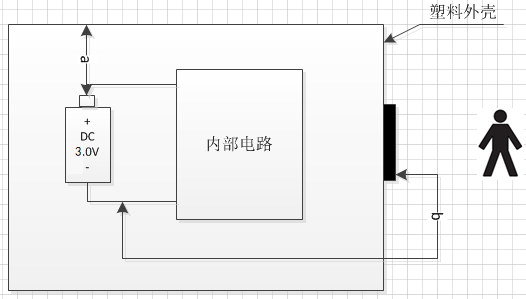
绝缘图
电气绝缘表
| 路径 | 绝缘类型 | 参考电压 | 爬电距离要求值(mm) | 电气间隙要求值(mm) | 爬电距离测量值(mm) | 电气间隙测量值(mm) |
|---|---|---|---|---|---|---|
| 带电部件与未保护接地外壳部分之间 | DI/RI | d.c.3.0V | 3.4 | 1.6 | >4.4 | >2.1 |
| 应用部分与带电部分之间 | DI/RI | d.c.3.0V | 3.4 | 1.6 | >4.4 | >2.1 |
文档控制: - 编制部门: 质量保证部 - 审核部门: 技术部 - 批准人: 总经理 - 生效日期: 2025年12月17日 - 版本: v1.0